Introduction of Akihiro Goto's research
新たな光遺伝学による記憶の長期保存の細胞機構の解析 (~2021)
Goto A, Bota A, Miya K, Wang J, Tsukamoto S, Jiang X, Hirai D, Murayama M, Matsuda T, McHugh T, Nagai T, and Hayashi Y.
Stepwise synaptic plasticity events drive the early phase of memory consolidation.
Science 374(6569) 857-863, 2021.
記憶の固定化
記憶は脳内のいつどこで形成され、保存されるのか?これは神経科学における大きなテーマです。また記憶の長期的な保存は我々の生活に不可欠な機能です。長期記憶と短期記憶は脳の別領域で保存されると考えられ、H.M氏の事例よく知られています。てんかんの発作を軽減するために海馬を除去したH.M氏は、子供の頃の記憶は保持していましたが、手術直前の記憶は思い出せませんでした。この事例は、学習後の記憶は海馬で一時的に保存されていることを示唆しています。その後、実験動物を用いた薬剤投与実験、破壊実験や遺伝子操作実験などにより、学習後の記憶は時間の経過に伴って海馬から皮質に移行し、より安定して長期的に保存されることが明らかとなりました。現在ではこの過程は「記憶の固定化」として知られていますが、細胞レベルで記憶がいつどこで保存されているかは不明でした。
シナプス長期増強(LTP)
脳は膨大な数の神経細胞によって構成されており、それらの神経細胞同士はシナプスを介して情報伝達をしています。そのシナプス伝達効率の変化はシナプス可塑性と呼ばれ、細胞レベルの記憶現象だと考えられています。シナプス可塑性の代表的な現象の1つに、シナプス伝達効率が長期的に増強するシナプス長期増強現象 (long-term potentiation; LTP)が知られています(図1)。LTPが学習後に脳内のいつどこで誘導されているかを調べることで、細胞レベルでの記憶の所在を同定することができます。しかしながら、学習後にどのようなタイムラインでLTPが起きているかを厳密に検討することは技術的に困難でした。例えば薬物実験では投与部位で作用し続けてしまうため、狙った時間でのみLTPを阻害することが困難であった。そこで我々はLTPが起きる時空間情報が得られる新たな技術の開発に取り組みました。

図1. 海馬スライスから長期増強(LTP)を記録した実験例。CA3のシナプス前線維を刺激し、CA1での応答を観測する。高頻度刺激を与えると、その後のシナプス伝達が長期増強される。
LTPの分子メカニズム
中枢神経系では、シナプスは樹状突起スパインと呼ばれるキノコ茸状の構造に形成されます。LTPに伴いスパイン構造は拡大しアクチン重合に依存して拡大します。所属研究室(林研)ではアクチン重合を担う因子がLTP誘導に伴いどの様に挙動するかを調べました(Bosch2014Neuron)。LTP誘導、多くの因子がスパイン内に流入しましたが、その中でもアクチン制御因子であるcofilinが特に顕著でした(図2)。LTP誘導後に、cofilinはシナプスへ急速に流入し、スパイン頭底部に集積して、アクチンと安定した複合体を形成しました。Cofilinは元々線維状アクチン(F-アクチン)を切断する分子として同定されましたが、高い濃度下では寧ろ安定化することが知られています。林研ではcofilinとF-アクチンは1:1に近い密度で相互作用し、F-アクチンを安定化し、これによりスパインが拡大することを示しました。
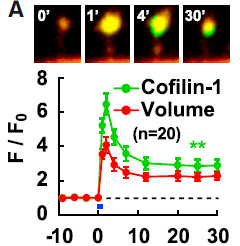
図2. 赤色蛍光タンパク質(赤、形態を示す)とcofilin-GFP(緑)を共発現した海馬神経細胞の樹状突起スパインの2光子画像。LTP誘導によりスパインが拡大し、同時にcofilinがスパイン頭底部に集積する。Bosch2014Neuronより転載
光によるLTP解除法の開発
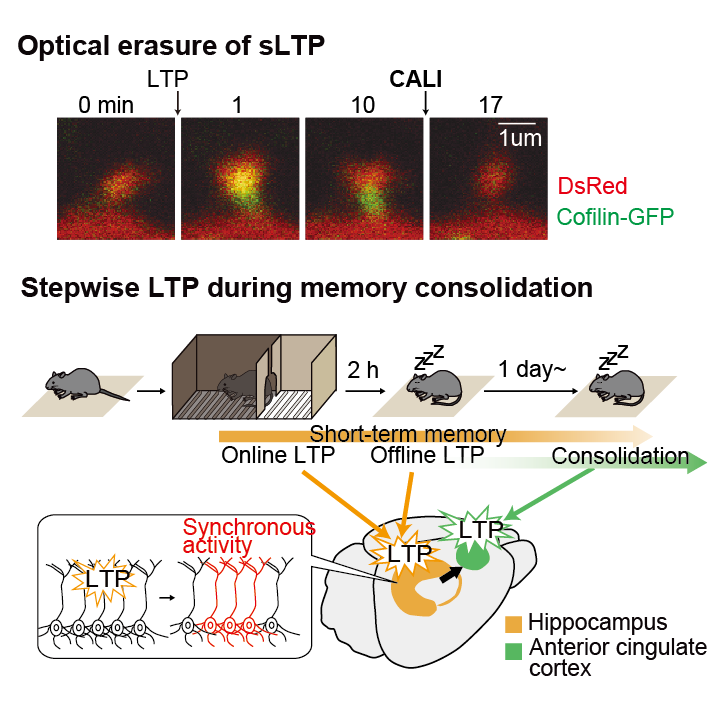
以上の先行研究を受け、cofilinを不活化すれば一旦成立したLTPを消去することができると考えました。SuperNovaという光増感たんぱく質は光照射により活性酸素を発生し、近傍のたんぱく質のみを不活化します。このCALI (chromophore-assisted light inactivation)と呼ばれる技術を用いることで、cofilinを光で不活化が可能となります(図3)。cofilin-SuperNova融合タンパク質とcofilin-GFPを神経細胞に共発現し、LTPを誘導した後、スパインに光を照射しCALIを誘導しました。その結果cofilin-GFPのスパイン集積と共にLTPが解除されました。つまりCofilinとF-アクチンとの結合は協働的であるため、一部のcofilinが不活化するだけで他のcofilin分子もF-アクチンから解離するのではないかと考えられます。

図3 LTP誘導によるスパイン頭底部へのcofilin集積と、CALIによる解除。(左)SuperNovaに光照射すると活性酸素が産生され、融合されたcofilinが不活化される。(右)赤色蛍光タンパク質(赤、形態を示す)とcofilin-GFP(緑)、cofilin-SuperNova(図には示されていない)を共発現した海馬神経細胞の樹状突起スパイン。LTP誘導によりスパインが拡大し、同時にcofilinがスパイン頭底部に集積する。光照射によりCALIを誘導すると、cofilinの集積がなくなり、同時にスパインが縮小する。スケールバー1 µm
次にスライス全体に光を照射したところ、LTPが誘導されたスパインのみが縮小し、LTPが誘導されていないスパインには影響がありませんでした(図4)。つまり、CALIの影響がLTPに特異的であることを示しています。また縮小したスパインに再度LTPを誘導したところ、正常に誘導できたことから、CALIによるLTP解除は可逆的な反応であり、単なるスパインの破壊ではないことを示しています。
またこの効果には時間枠があり、LTP誘導前や誘導後30分以降に光照射した場合には効果はありませんでした。つまりLTPの誘導後30分以内に光を照射することで、LTPが解除できることが分かりました。
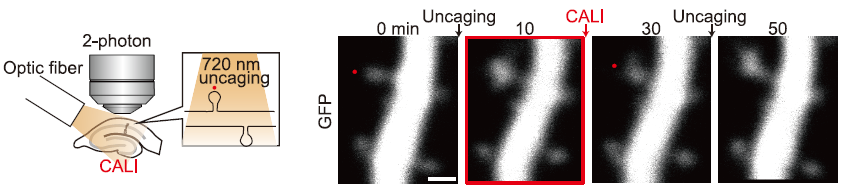
図4.Goto et al., Science 2021 Fig1より転載。光ファイバーによりスライス全体を照射。赤点でアンケージングによりLTPを誘導。
この技術は以下の点で画期的です。まず、外部からCFL-SNを発現させて光を当てるだけで、LTPに関与する内在性のcofilinの機能も阻害してLTPを解除できる点。次に、細胞全体に光を照射しても、LTPによりcofilinが集積しているスパインに効果があるため、光の影響はLTPに特異的です(図5)。最後に、光の影響は、LTPの直後から30分までに限定できる点です。既存の技術ではLTPの直後や時間的に限定された操作が難しかったため、本技術によりLTPの時空間解析が可能となります。
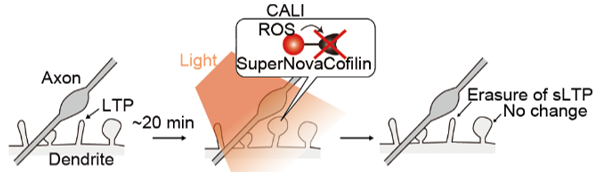
図5.光によるLTPの特異的な解除。LTPによりスパインが拡大し、その30分以内に光を照射しcofilinを不活化することでLTPが特異的に解除される
Cofilinの光不活化による記憶の消去
以上の技術を用いて生体の脳内でLTPを解除することで、記憶が消去できるかを検討しました。CFL-SNを脳内に発現させるためのアデノ随伴ウイルス(AAV)を作成し、海馬の興奮性神経細胞にのみCFL-SNを発現させました (図6)。海馬に光を照射するために光ファイバーの先端が海馬の直上に位置するように手術で埋め込み、記憶を定量化するため、学習タスクであるInhibitory Avoidance test (IA test)を用いました。IA testはマウスが自由に行き来できる暗室と明室の2つの区画がある箱で行います。マウスは暗室を好むので、マウスを明室に入れると通常30秒以内に明室から暗室に移動します。しかし暗室に入った直後に電気刺激を与えると、翌日再びマウスを明室に入れてもすぐには暗室に入らなくなります。この暗室に入るまでの時間の遅滞を測定することで記憶を評価することができます。1日目のIA testの1分前、2、5,10,20,60, 120分後にそれぞれ光を照射したところ、IA test の2分後から20分後の間で光を照射した場合に、翌日の暗室に入るまでの時間の延長が見られなくなりました。つまり、IA testによる学習2分後から20分後の間でCALIを誘導した場合にのみ、記憶が消去されることが分かりました。以上の結果は脳スライスの結果と一致し、生体内においても20分以内のLTPを特異的に解除することで特定の記憶のみが光により消去できることを示しています。またこのことは学習直後に海馬でLTPが誘導されており、それが記憶の形成に重要であることを証明しています。

図6. (左)海馬組織画像。海馬CA1に赤色(CFL-SN発現)が、その直上に光fiber跡が見える。スケールバー300mm。(中)IAテストとCALI実験の模式図。(右)1日目のIA test電気刺激の1分前、2, 5, 10,20,60, 120分後にそれぞれ光を照射し、2日目の遅滞 (=記憶成績)を観測。
さらに、LTP解除により、20分以内の記憶が特異的に消去されるかを確認しました。そのために、Context AとContext B という色、形、匂いの異なる2つの箱で記憶を形成させました(図7)。Context Aでの学習から2時間後にContext Bで学習を行い、その直後にCALIを行いました。すると、Context Bの記憶のみが消去されました。つまり、光をあてる20分以内に形成された記憶が特異的に消去されていることが示されました。

図7.Goto et al., Science 2021 Fig2より転載。(左)Day1にContext A、Bで異なる記憶形成し、CALIを実行。(右)それぞれの箱でのcrossover latency。
睡眠時における海馬のシナプス可塑性
以上の結果から、学習の直後に海馬でLTPが誘導されていることを示しましたが、我々はさらにその後の睡眠の役割にも興味を持ちました。なぜなら睡眠は記憶、学習に重要であることが知られているからです。例えば睡眠中の海馬では覚醒時の神経活動が繰り返されるリプレーという現象が知られており、この現象によって再度シナプス可塑性が起こると想定されています。そこで我々は、学習後の睡眠中に海馬で再びLTPが起きる可能性について検討しました。そのために、睡眠中、あるいは覚醒中にのみ光を照射するシステムを村山研から導入し、CALI用のセットアップを自分たちで確立しました (図8)。脳波と筋電図を測定することでマウスの睡眠状態を自動的に検出し、20分間睡眠あるいは覚醒状態が続いた時にのみ海馬に光照射しました。光照射によって20分以内に誘導されたLTPを解除できるため、これにより睡眠中あるいは覚醒状態におきたLTPのみを解除することができます。IA testの電気刺激と同日の睡眠中にCALIを行なった場合、翌日に記憶成績の低下が見られました。一方、覚醒中のCALIでは効果が見られませんでした。また、IA testの電気刺激の翌日にCALIをしても効果はありませんでした。この結果は、学習直後に加えて、その後の睡眠中にも海馬でLTPが誘導されていることを示しています。以上から、学習直後と同日の睡眠中に2段階のLTPが海馬で起きることで、記憶が形成されることが明らかとなりました。学習直後に起きるLTPを「オンラインLTP」、その後の睡眠中に起きるLTPを「オフラインLTP」と呼ぶことにしました。

図8. 学習後の睡眠中での光照射実験の模式図と実験例。黒線が睡眠状態を、赤色が光を照射したタイムポイントを示している。覚醒中のみ(上)と睡眠中のみ(下)光照射した例を示す。バーグラフは電気刺激の同日と翌日(2日目)に光照射した1日後の記憶成績。
オンラインLTPとオフラインLTPによる神経活動形成
以上から、海馬では学習時と同日の睡眠中の2回LTPがいずれも記憶に必要であることが明らかとなりましたが、この両者にどのような機能的な差異があるのでしょうか。そこで、LTPによって記憶が形成される際、どのような神経活動が新たに形成されるかを検討しました。そのためにInscopix社のnVistaという頭部接着型の小型顕微鏡を用いました(図9)。nVistaにはLED, CCDなどの光学系が搭載されていますが、総重量が2gほどなので自由運動マウスの頭部に取り付けた状態でカルシウムイメージングを行うことができます。海馬CA1にCFL-SNとGCaMP6fを同時に発現させ、IAタスクによる学習前後のカルシウムイメージングを行いました。オンラインLTPを解除するグループでは電気刺激後2分後、オフラインLTPを解除するグループでは電気刺激後2時間後にCALIを行いました。
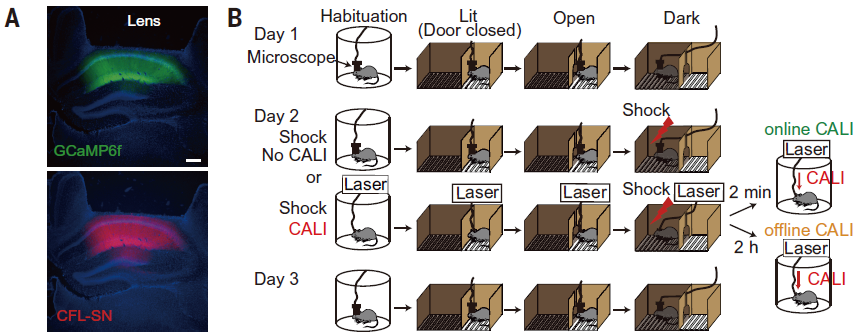
図9. A AAV9-CAG-DIO-CFL-SN-P2A-GCaMP6fをCaMKII-Creマウスにインジェクション。B実験デザイン。Goto et al., Science 2021 Fig4より転載
まず、学習した空間(IAテスト)に対する活動変化を検出するため、学習環境(IAテスト箱)とそれ以外の環境(円柱の箱)における神経活動の比率を計算しました。CALIを行わなかったコントロールマウスにおいては学習後、IAテスト箱でより選択的な発火をする細胞が上昇することがわかりました(図10)。一方、オンラインLTPを解除すると学習空間に対する選択性の上昇は見られませんでした。オフラインLTP解除では学習空間に対する選択性への影響は見られませんでした。以上から、学習直後のオンラインLTPにより、学習空間における神経活動の選択性が上昇することがわかりました。
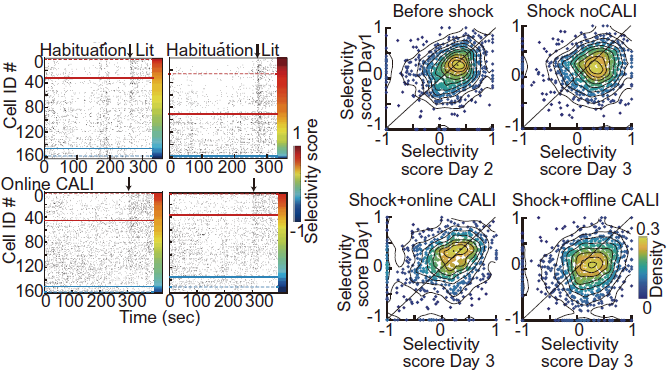
図10. Goto et al., Science 2021 Fig4より転載。(左)Habituation(円柱ケージ)とIAテストの明室におけるラスタープロット。赤線より上が明室で、青線より下が円柱ケージで特異的に発火する細胞。コントロールでは学習後に明室で特異的に発火する細胞が増えるがオンラインLTPを解除すると抑制される。(右)明室での特異的発火の指標(selectivity score)に基づいた細胞の分布密度。対角線上に近い細胞ほど変化が少ない。CALIを行わなかったグループではDay3でselectivity scoreが高くなる細胞が増えるが、オンラインLTPを解除すると抑制される。
それでは睡眠中のオフラインLTPはどのような役割を担っているのでしょうか?記憶を担う細胞の活動は同期性や協調性をもっていると考えられています。そこで学習前後における同期発火を検出するために、カルシウムトレースのPCA解析を行いました。検出された細胞群のカルシウムトレースにPCAを行うと、大きな偏差として検出されたタイムポイントでは同期して発火を見ることができます(図11F,G)。学習前(Day1)と学習後(Day3)のカルシウムトレースを連結してPCAを適用すると、学習後に大きな偏差を見ることができ、学習後に同期発火が増加していることを示しています。また各フレームにおいて発火する細胞数をカウントしたところ、より多くの細胞が同時に発火するフレームが学習後に増えていることも分かりました(図11H)。オンラインLTPを解除した場合とオフラインLTPを解除した場合の両方において、同期発火の増加が見られなくなりました。つまり、学習直後のオンラインLTPとその後の睡眠中のオフラインLTPによって同期発火性を獲得することが分かりました。またIAタスクで暗室をのぞき込んで後ずさりしている時、つまり電気刺激の記憶を想起している時に細胞の同期発火を観察しました(図11I)。同期発火細胞が記憶に関与していることを示唆しています。
さらに学習後に学習空間に特異的な発火を示す細胞がより同期発火性を獲得しやすいことも確認しました。つまり、online LTPによって海馬細胞は学習空間に特異的に発火するようになり、その後の睡眠中のoffline LTPによってさらに同期発火を獲得していることを示唆しています。
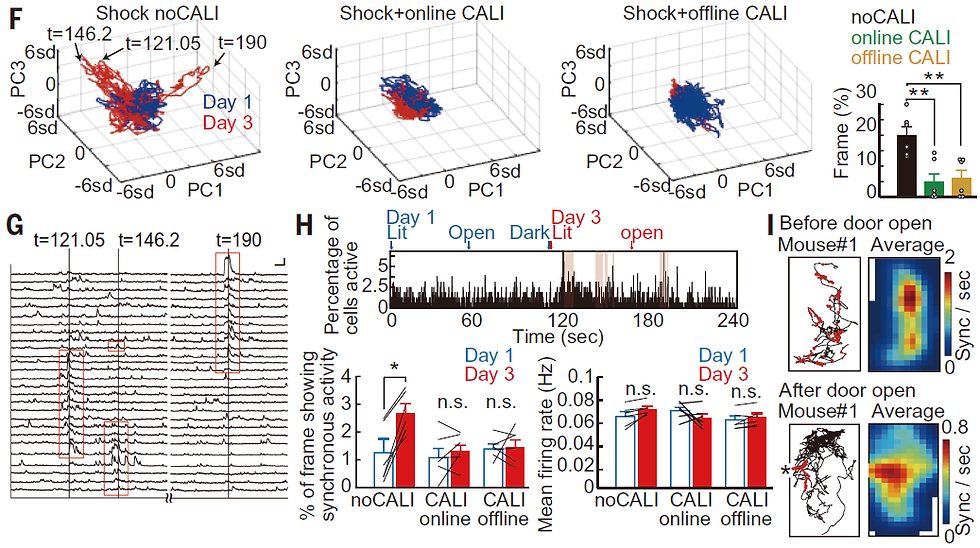
図11. Goto et al., Science 2021 Fig4より転載。詳細は本文参照
皮質におけるシナプス可塑性
次に、記憶が皮質に移行する時間と脳領域を検討しました。我々は大脳皮質の前帯状皮質という領域に注目しました。この領域は、古い記憶(マウス実験の場合は数週間)を想起する時に活性化され、さらに局所麻酔薬で不活化すると想起できなくなることが知られています。一方新しい記憶(前日)の想起には必要ありません。そこで我々はAAVを用いて前帯状皮質の興奮性神経細胞にのみもCFL-SNを発現させ、海馬と同様のCALI実験を行いました(図12A)。学習直後に光を照射したところ、海馬とは異なり、記憶成績に影響はありませんでした(図12B)。さらに学習後8時間にわたって20分毎に光を照射しても影響がなかったことから、海馬とは異なり、前帯状皮質では学習当時にはLTPが誘導されていないことが分かりました(図12C)。さらに学習の翌日の睡眠中にCALIを行ったところ、記憶が消去されました(図12D,F)。この効果は学習25日目には見られなくなりました(図12E)。このことは、前帯状皮質では学習の翌日の睡眠中にLTPが誘導されることを示しています。これまでの先行研究から、前帯状皮質では学習後に記憶を担う細胞がタグ付けされ(silent engram cellとも呼ばれる)、その後徐々に時間をかけて学習を担う細胞になると考えられていました。本研究の結果は、学習の翌日の睡眠中に前帯状皮質でシナプス可塑性が誘導されることが記憶に重要であり、その後の皮質での長期記憶の形成に重要であることを示唆しています。
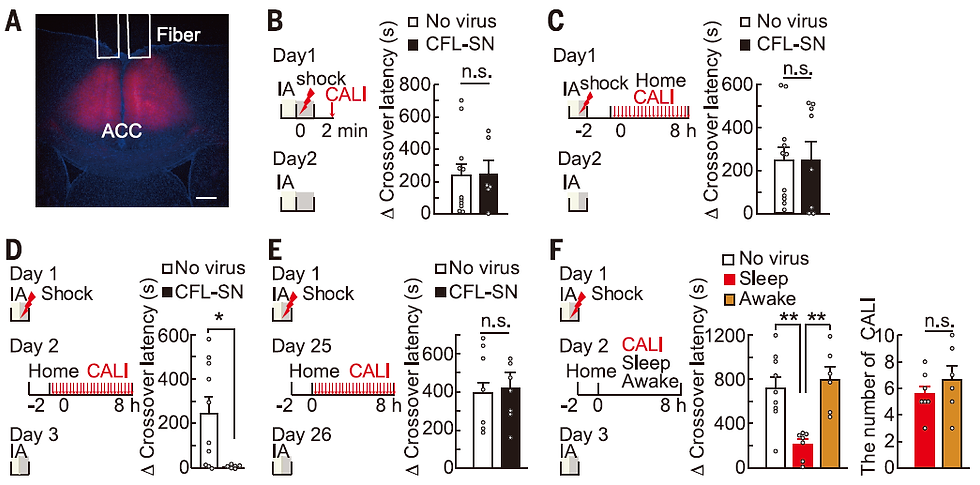
図12. Goto et al., Science 2021 Fig5より転載。詳細は本文参照
まとめと今後の展望
以上の結果から、学習直後のLTP (オンラインLTP)とその日の睡眠中のLTP (オフラインLTP)によって海馬で記憶が形成され、さらにその翌日の睡眠中に前帯状皮質でLTPが誘導されることを明らかにしました(図13)。以上の結果は、細胞レベルの記憶であるLTPに基づいた記憶固定化の新たな時空間モデルです。

図13. 海馬と前帯状皮質におけるLTPの時間枠(上)。海馬のonline LTPとoffline LTPによって獲得される細胞活性(下)
NMDA受容体依存型のLTPは海馬や前帯状皮質のみならず、記憶に関与した多くの脳領域に共通したメカニズムであることから、NMDA受容体依存型のLTPを光で解除する本技術は、記憶に関与した脳の多領域でLTPの時間枠を検出することができます。またカルシウムイメージングと組み合わせることで、そのLTPにより形成される細胞(エングラム)の活動を詳細に解析することが可能です。現在、さらにターゲットを広げ、皮質、側坐核といった記憶に重要な領域も解析することで、脳内の記憶処理の全容を細胞レベルで解明することを目指しています。
また本技術を神経疾患の治療に応用することも可能だと考えています。LTPは記憶の形成だけでなく、記憶の想起時にも誘導され、記憶を更新します(再固定化)。この記憶想起時にたんぱく質合成を阻害すると、想起した記憶が消去されることが知られています。したがって、光によるLTP解除法を用いれば、記憶の想起時にのみ光を照射してLTPを解除することで、過去の記憶を消去できると考えらます。PTSD(心的外傷後ストレス障害)治療に応用することで、心的外傷となった記憶を特異的にかつ非侵襲的に取り除くことが可能となると期待されます。